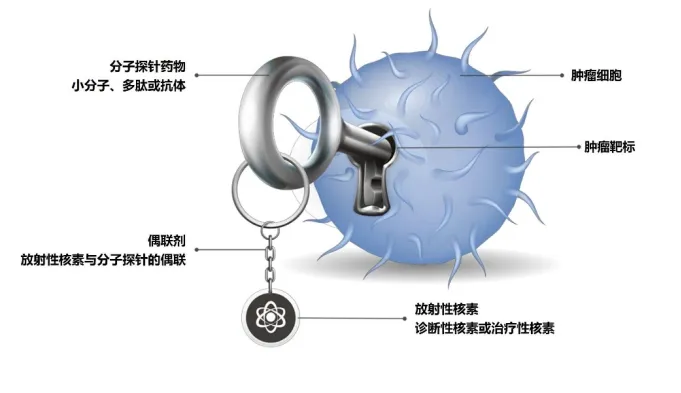
GPN01530是一款靶向FAP的小分子RDC药物,其优化了FAP配体的结构,提高了其在肿瘤组织中的摄取,同时降低其在正常组织中的摄取;
与其它FAP配体相比,GPN01530表现出快速的肿瘤靶向、更高的肿瘤摄取和更优的药代动力学特性;
GPN01530项目的早期研究基于本集团在成都核药基地的放化标记平台及动物分子影像平台完全独立自主实现。
近日,远大医药(0512.HK)自主研发的全球创新放射性核素偶联药物(RDC) GPN01530近日获得美国食品药品监督管理局(FDA)正式批准开展用于诊断实体瘤的I/II期临床研究,这标志着本集团在核药抗肿瘤诊疗领域的全球化布局上又迈出坚实一步。
作为本集团首款获得FDA批准开展临床研究的自研RDC产品,GPN01530临床研究的成功获批为本集团核药产品管线的国际化开发提供了重要范式,是本集团核药抗肿瘤诊疗板块全球化研发与注册进程中的重要里程碑,充分体现了本集团在前沿核药技术平台建设、国际化临床开发与注册申报等方面的综合实力。本集团将依托“中美双报”的国际化注册路径,持续推进GPN01530的全球研发与注册工作,并以此为基础,进一步深化该板块的全球化发展战略,积极推动更多自主研发的创新核药产品的国际临床研究与注册申报工作,不断提升本集团在核药抗肿瘤诊疗领域的核心竞争力与国际影响力。
GPN01530优化配体结构 或提供全新肿瘤诊断方案
关于GPN01530
GPN01530是一款靶向成纤维细胞活化蛋白(FAP)的小分子RDC药物。FAP是肿瘤相关成纤维细胞(cancer associated fibroblasts, CAFs)的重要标志物之一,参与细胞外基质重塑、肿瘤细胞增殖调节和肿瘤免疫抑制等过程促进肿瘤的生长和侵袭,是肿瘤诊疗的新型特异性靶点。研究表明,FAP在正常组织中不表达或低表达,但在90%的上皮性肿瘤组织和多种肿瘤微环境的CAFs中高表达。GPN01530特异性靶向FAP为多种恶性肿瘤的诊断及治疗提供了新的可能。
目前临床上常用的PET/CT显像剂是氟[18F]-氟代脱氧葡萄糖(18F-FDG),通过对病灶葡萄糖代谢水平的高低对疾病做出相应判断和评估,但其灵敏度较低(40%~68%),在肿瘤早期诊断中的价值有限。而靶向FAP的显像剂具有泛实体瘤应用前景和灵敏度高的特点,已成为放射性药物研究的热门靶点之一。[1]本集团自主研发的GPN01530优化了FAP配体的结构,提高了其在肿瘤组织中的摄取,同时降低其在正常组织中的摄取[2]。临床前研究结果表明,本产品与其它FAP配体相比,表现出快速的肿瘤靶向、更高的肿瘤摄取和更优的药代动力学特性。此外,在已开展的IIT人体研究中显示,本产品安全性良好,具备快速的背景清除、强而持久的病灶摄取,与18F-FDG相比表现出更优的临床图像对比度和阳性病灶的准确检出率。基于已有临床前及临床研究结果,本产品显著提升了FAP靶点类的RDC药物的诊断效能,并有望为广大的实体瘤患者提供一款全新的肿瘤诊断方案。
GPN01530项目的早期研究基于本集团在成都核药基地的放化标记平台及动物分子影像平台完全独立自主实现,一站式完成了标记工艺开发及动物成像研究工作,并依托符合药品生产质量管理规范(GMP)的生产线实现了注册批的生产及检验放行。本项目也是成都核药基地自今年6月投入运营以来,第一个进入FDA临床阶段的自主研发产品,展现出了该技术平台优秀的临床前开发及国际注册能力。
关于癌症
癌症是世界范围内导致死亡的主要因素之一。根据GLOBOCAN的数据,2022年全球癌症新发病例约2000万,死亡病例约970万,预测到2030年全球癌症新发病例将接近2400万,死亡病例将接近1200万。[1]在可预见的未来,癌症都将是威胁人类健康的重大公共卫生问题。
目前,普遍认为精准的诊断与治疗对于癌症的预后有着非常重要的意义,因此,具有诊疗一体化潜力的放射性药物已成为目前研究的热点领域。据统计,全球放射性药物市场规模自2018年的50亿美元增至2024年的97亿美元,复合年增长率达11.7%。预估至2035年将攀升至573亿美元,2024至2035年间复合年增长率为17.5%。同期在中国市场,规模从2018年的人民币36亿元增长至2024年的人民币74亿元,复合年增长率为13.0%。至2035年,预计将达到人民币758亿元,2024至2035年间复合年增长率达23.5%。[1]成像技术和放射性配体疗法持续进步以及人口老龄化的加重,放射性药物市场将会延续高速增长势头。未来若GPN01530开发顺利,该产品有望成为破解实体瘤诊断困境的重要突破口,重塑实体瘤诊断格局,抢占全球领先的市场地位,并为全球患者带来新的希望。
持续推进创新产品研发 夯实全球核药领军地位
本集团在核药抗肿瘤诊疗板块已实现了研发、生产、配送、销售等多个环节的全方位布局,板块全球员工超过900人,以波士顿、成都为核心的研发基地,波士顿、法兰克福、新加坡、成都所在的生产基地以及覆盖全球50多个国家和地区的销售网络为基础,本集团已实现了全球化的核药产业链布局。
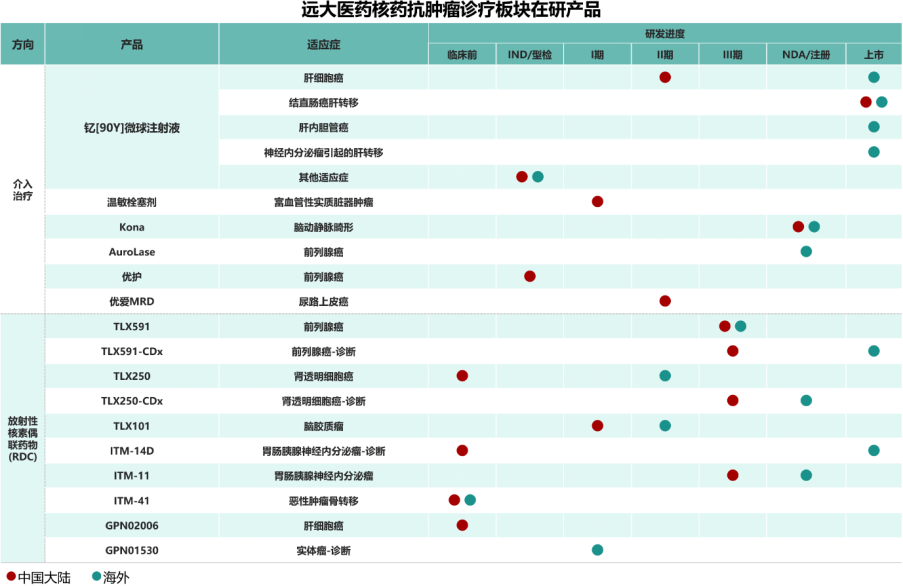
本集团联合Sirtex Medical Pty Ltd并与Telix Pharmaceuticals Limited (ASX: TLX; NASDAQ: TLX)和ITM Isotope Technologies Munich SE (ITM SE)合作,搭建了具有国际化一流水平的肿瘤介入研发平台和RDC药物研发平台。围绕肿瘤诊疗一体化的治疗理念,目前在研发注册阶段已储备16款创新产品,涵盖68Ga、177Lu、131I、90Y、89Zr在内的5种放射性核素,覆盖了肝癌、前列腺癌、脑癌等在内的7个癌种;早期研发阶段以RDC药物为主,产品储备10余款。在产品种类方面,涵盖诊断和治疗两类核素药物,为患者提供多适应症治疗选择、多手段且诊疗一体化的全球领先的抗肿瘤方案。[3]
板块内创新产品全球研发工作顺利推进。中国方面,易甘泰®钇[90Y]微球注射液于2022年1月顺利上市,用于治疗结直肠癌肝转移,并于2025年5月获得中国药监局批准开展治疗不可切除HCC的II期注册性临床试验;全球创新温度敏感性栓塞剂GPN00289于2025年10月完成了注册性临床研究的全部患者入组。海外注册方面,SIR-Spheres®钇[90Y]微球注射液(易甘泰®)于2025年7月在美国提前正式获批新适应症,用于治疗不可切除HCC,标志着SIR-Spheres®钇[90Y]微球注射液成为全球首个且唯一获FDA批准用于不可切除HCC和结直肠癌肝转移双重适应症的选择性内放射治疗产品;于2025年9月获欧洲CE标志认证新增多种肝癌适应症,进一步推动该产品在不可切除肝癌治疗领域的全方位覆盖,实现市场空间战略级扩容,充分彰显本集团优秀的海外临床注册与商业化运营能力,为后续自研创新核药产品的全球开发提供重要保障;同时,相关海外临床数据也将为该产品在中国拓展肝癌相关适应症提供关键支持;此外,本集团正携手中外专家合作开发钇[90Y]微球注射液的其他适应症,并将采用“中美双报”的国际化注册路径,加速该产品的全球市场拓展。
目前,本集团在核药抗肿瘤诊疗板块已有五款创新RDC获批开展注册性临床研究,其中四款已进入III期临床阶段,包括诊断前列腺癌的产品TLX591-CDx、治疗前列腺癌的产品TLX591、诊断透明细胞肾细胞癌产品TLX250-CDx以及治疗胃肠胰腺神经内分泌瘤(GEP-NETs)的产品ITM-11,近日,本集团合作伙伴ITM SE在美国递交的ITM-11上市申请正式获得FDA的受理。此外,全球创新、基于放射性核素-抗体偶联技术的靶向磷脂酰肌醇蛋白聚糖3 (GPC-3)的诊断型放射性药物GPN02006早前在中国开展的研究者发起的临床研究(IIT临床研究)取得了里程碑式突破,并在2025年北美核医学与分子影像学会(SNMMI)年会斩获口头报告,该产品极具潜力,有望成为全球首个针对GPC-3靶点的肝细胞癌(HCC)诊断类RDC产品。截至目前,本集团是进入中国III期临床研究中诊断和治疗类RDC创新药总计储备最多的企业,也是全球范围内在核药抗肿瘤领域拥有最丰富产品管线和诊疗一体化布局的创新药企之一。
关于本集团成都核药研发及生产基地
本集团位于中国四川省成都市温江区的远大医药放射性药物研发及生产基地已于2025年4月竣工验收,5月获得国家生态环境部颁发的甲级《辐射安全许可证》,6月底正式投入运营。该基地为全球首个核药全产业链闭环平台,覆盖“同位素制备-核药研发-生产临床-商业化”全链条,形成从早期研发到临床转化到上市销售的全生命周期管理能力,研发效率国际领先;解决了核药“卡脖子”难题,100%自主生产破解进口依赖困局,14条高标准GMP生产线实现多品种、规模化制备需求,真正实现了创新核药产品研发、生产、销售全产业链的完全自主可控;建立全流程智能管理体系,核电级安全与无人化智造,可实现辐射“零泄漏”,污染“零外排”,职业照射“零超标”,达到全球顶尖核设施标准;建立世界一流研发生产质量与运营体系,是目前国际范围内核素种类最全、自动化程度最高的智能工厂之一。该研发及生产基地将进一步夯实本集团核药产业的基础,加速全球创新研发管线的落地,推动本集团实现核药产业的高质量发展,培育高价值重磅品种,为本集团放射性药物的国产化落地奠定坚实的基础。
未来,本集团将持续加强核药抗肿瘤诊疗板块的研发和建设,丰富和完善产品管线及产业布局,形成以易甘泰®钇[90Y]微球注射液为核心的核药抗肿瘤诊疗产品集群,持续夯实本集团在全球核药抗肿瘤诊疗领域领军企业地位。
远大医药集团有限公司董事会表示:“本集团一直高度重视创新产品和先进技术的研发,以患者需求为核心,以科技创新为驱动,针对尚未满足的临床需求,加大对全球创新产品和先进技术的投入,丰富和完善产品管线及产业布局,采用‘全球化运营布局,双循环经营发展’策略,形成国内国际双循环联动发展并相互促进的新格局,充分发挥本集团的产业优势和研发实力,快速将科技创新产品落地上市,为全球患者提供更先进更多样的治疗方案。”
[1]根据现有公开信息;
[2]基于GPN01530研究数据;
[3]研发风险提示:文中提及的在研产品尚未获得上市批准,其安全性和有效性需经完整临床研究及监管审批确认,不构成任何治疗承诺或商业推广。对在研产品上市时间的任何预期仅为基于当前情况进行初步判断的前瞻性表述,具有相当风险和不确定性。