当地时间11月16日,远大医药(0512.HK)中国创新经导管二尖瓣缘对缘修复器械NeoNova®的两年期随访数据于全球顶尖心脏瓣膜介入会议PCR London Valves期间首度披露,该研究结果由厦门大学附属心血管病医院王焱教授团队公布,为二尖瓣反流(MR)的治疗提供了新的临床证据,同时证实该产品蕴含突破性临床应用前景。

两年期随访结果概览
NeoNova®研究为一项前瞻性、多中心研究,覆盖了全国23家研究中心,共纳入123例显著症状性退行性二尖瓣反流(DMR)≥3+患者。本研究旨在评估NeoNova®系统在治疗DMR患者的两年期安全性和有效性。

生存率与无主要不良事件率:随访至12个月时,95.12%的患者未发生主要终点事件(包括全因死亡率、瓣膜功能障碍手术及MR>2+);至24个月时,这一比例仍保持在87.8%,显示出NeoNova®的长期稳定性和安全性。
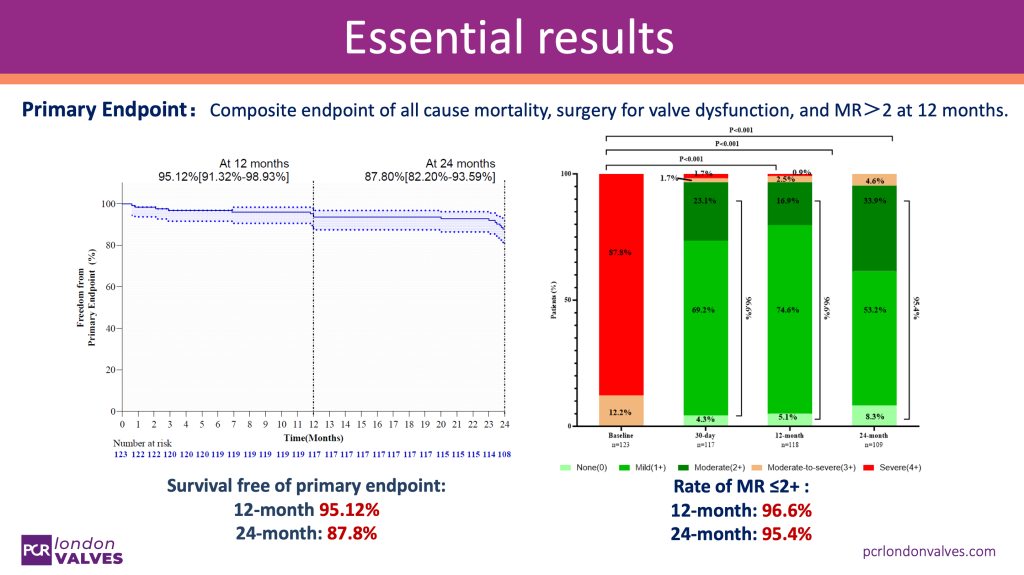
二尖瓣反流程度改善:12个月时,96.6%的患者二尖瓣反流程度降至轻度或以下(MR≤2+);24个月时,这一比例维持在95.4%,研究者认为,这些数据证实该产品的持续性治疗效果。

关于二尖瓣疾病
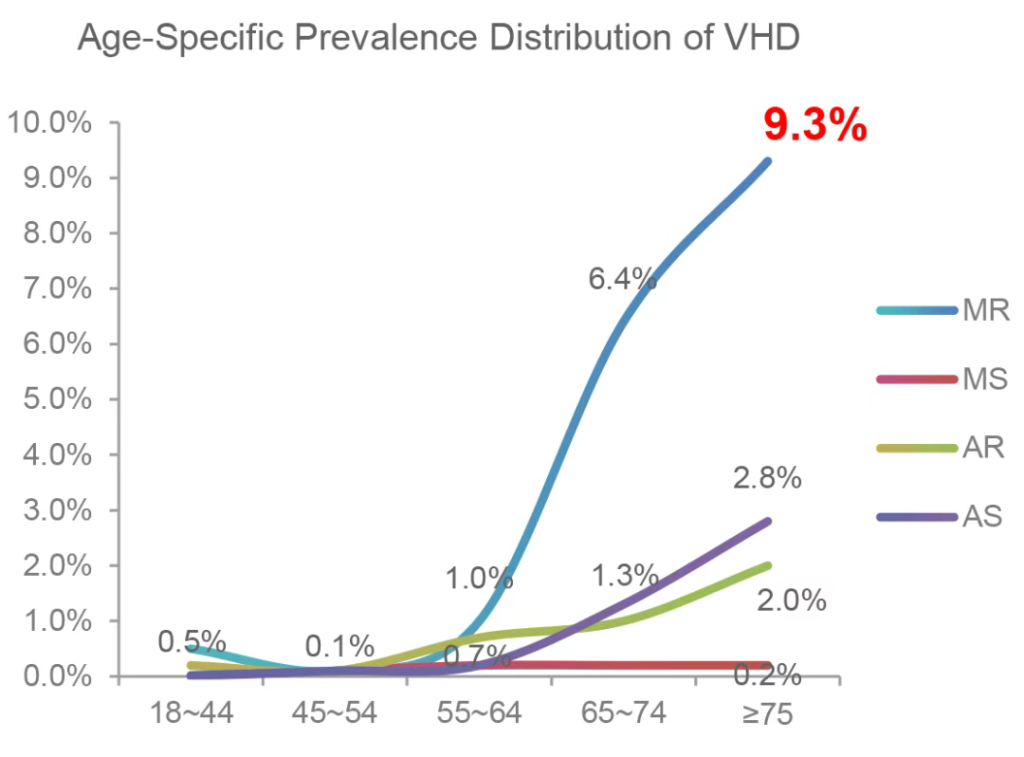
二尖瓣反流作为中国最常见的心脏瓣膜疾病之一,年龄≥75岁人群二尖瓣反流患病率高达9.3%,全国约750万二尖瓣反流患者需要介入治疗,其中550万患者为重症病例,然而我国50%二尖瓣反流患者因高龄外科开胸手术高风险不能接受外科治疗,全国二尖瓣反流年手术量仅约4万例,仅占需要治疗二尖瓣反流患者的0.5%,可见经导管二尖瓣缘对缘修复术(TEER)具有广泛的临床应用前景。NeoNova®系统的出现,将为这部分患者提供一种新的治疗选择。
关于NeoNova®系统
NeoNova®系统采用了中等尺寸间隔器设计,确保与夹合器严格对齐,减少组织损伤;配备防滑脱保留元件,通过优化长度和角度组合,有效防止瓣叶滑脱;同时,以适宜的夹持力实现瓣叶可靠夹持,保持瓣叶弹性,保护其免受损伤。该产品由臻亿医疗全资子公司杭州端佑医疗科技出品、远大医药进行推广。今年2月获国家药品监督管理局批准上市,3月获国家C码,并已于全国全面开展临床植入。
持续推进高端医疗器械研发打造全球领先精准介入诊疗平台
心脑血管精准介入诊疗领域是远大医药核心战略领域之一,公司秉承“精准治疗”的理念,围绕通路管理、结构性心脏病及心衰三个方向进行全方位布局,搭建高端医疗器械产品集群,目前该板块已布局超过30款产品,其中通路管理方向已有22款产品在中国获批上市,结构性心脏病已有1款产品在中国获批上市。[1]
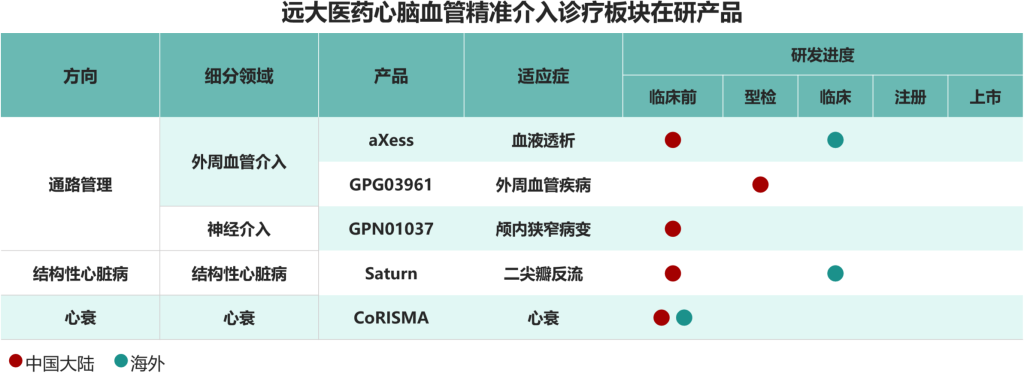
其中,本集团多极肾动脉射频消融系统铂睿时IberisTM于2025年2月获得国家药监局批准在中国上市,并已成功完成上市后临床应用;经导管二尖瓣夹系统NeoNova®和冠脉冲击波系统DEEPQUAKE-CTM分别于2025年2月和2025年6月获得国家药监局批准在中国上市;其他产品也在积极推进中国临床注册工作,力争在未来年度实现创新产品分阶段分梯次上市,带动该板块业务稳定增长。
远大医药在该板块已实现“无源+有源”创新器械平台的全面建设,其中,武汉光谷有源器械研发生产基地和常州无源器械研发生产基地,以及聚焦结构性心脏病领域的上海器械研发中心均已投入使用。目前本集团在该板块已经和美国、加拿大、德国、意大利、瑞士等多国临床中心或者研发平台进行技术合作,逐步开启迈向全球化研发新进程。公司致力于将该板块打造成为中国乃至全球领先的“心脑血管精准介入诊疗平台”。
[1]研发风险提示:文中提及的在研产品尚未获得上市批准,其安全性和有效性需经完整临床研究及监管审批确认,不构成任何治疗承诺或商业推广。
[2]免责声明:本文内容基于临床试验数据撰写,旨在学术交流与信息分享,并非产品广告宣传。文中提及的临床数据及结论均基于特定研究人群得出,个体疗效可能存在差异。实际治疗方案需由专业医师根据患者具体情况制定。